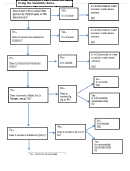
Solubility Rules
ADVERTISEMENT
Solubility Rules
Rule 1: Binary Acids: HCl, HBr, and HI are strong, all other binary acids and HCN are weak.
Strong acids are written in ionic form, weak acids are written in undissociated form
Rule 2: Ternary Acids: If the number of oxygen atoms in the inorganic acid molecule exceeds the
number of hydrogen atoms by two or more, the acid is strong. All organic acids (contain carbon)
will be considered weak.
Rule 3: Polyprotic Acids: In the second and subsequent ionizations the acids are always weak,
whether or not the original acid is strong or weak.
Rule 4: Bases: Hydroxides of the Groups 1 and 2 elements except beryllium are strong bases. All
others are weak.
Rule 5: Salts: Salts are written in ionic form if soluble and in undissociated form (solid) if
insoluble. (Use rules for salts below)
Rule 6: Oxides: Oxides are always written in undissociated form
Rule 7: Gases, liquids, and solids: Gases, liquids, and solids are always written in undissociated
form.
Solubility Rules for Salts (Ionic Compounds)
Soluble Compounds
Insoluble Compounds
Compounds of Group 1 elements
Carbonates (CO
3 ‐2
), chromates (CrO
4 ‐2
),
Ammonium (NH
4 +
)compounds
oxalates (C
O
4 ‐2
), and phosphates (PO
4 ‐3
),
2
Chlorides (Cl
), bromides (Br
), and iodides
except those of the Group 1 elements and
‐
‐
(I
), except those of Ag
, Hg
, and Pb
NH
‐
+
2 +2
+2
4 +
Nitrates (NO
3 ‐
), nitrites (NO
2 ‐1
), acetates
Sulfides (S
‐2
), except those of the Group 1
(CH
CO
2 ‐
), chlorates (ClO
3 ‐
), and
and 2 elements and NH
4 +
3
perchlorates (ClO
)
Hydroxides (OH
) and oxides
4 ‐
‐
Sulfates (SO
4 ‐2
), except those of Sr
+2
, Ba
+2
,
(O
‐2
), except those of the Group 1 and 2
Pb
+2
, and Hg
2 +2
elements, and NH
4 +
Background:
Solubility is not as “black and white” as the above chart makes it look. The chosen dividing line
between soluble and insoluble is 0.1M at 25 °C. Any substance that can form 0.1 M or greater is
considered SOLUBLE. Any substance cannot reach a concentration of 0.1 M is considered
INSOLUBLE. This dividing line was chosen because most substances form solutions either much
greater than or much less than 0.1M. If you find any discrepancies with the above table and a
solubility table from another source it is likely those substances are “slightly soluble” and the authors
had differing opinions of how to define those substances. Wondering what the “M” stands for? M
stands for molarity, which is a way to describe concentration – it means moles/liter.
References:
‐
‐
‐Brown, Lemay, Bursten, Chemistry: the Central Science, Pearson/Prentice Hall, Tenth Edition, 2006.
‐Smith, Hines, Smoot, Solving Problems in Chemistry, Glencoe.
ADVERTISEMENT
0 votes
Related Articles
Related forms
Related Categories
Parent category: Education
 1
1 2
2